Conocimientos del ámbito de la tecnología médica
El área de conocimiento de tecnología médica le ofrece una visión general de los cambios más importantes de la actualización de la norma DIN EN ISO 13485. Además, encontrará información sobre los temas de validación de procesos manuales y gestión de proveedores.
Hier finden Sie Antworten auf die folgenden Fragen:
- ¿Qué cambios ha traído la actualización de la norma DIN EN ISO 13485?
- ¿Es necesario validar los procesos manuales en la tecnología médica?
- ¿Qué es un archivo de historial de diseño y qué hay que tener en cuenta al crearlo?
- ¿Cómo se puede estructurar una gestión eficaz de los proveedores para garantizar la calidad de los procesos subcontratados?
¿Qué cambios ha traído la actualización de la norma DIN EN ISO 13485?
Extracto de los cambios más importantes de la nueva DIN EN ISO 13485:
- Requisitos reglamentarios adicionales en las áreas de validación, verificación, diseño y desarrollo
- La gestión de riesgos se tiene más en cuenta en el sistema de gestión de la calidad
- El requisito de validación del software se hace más explícito
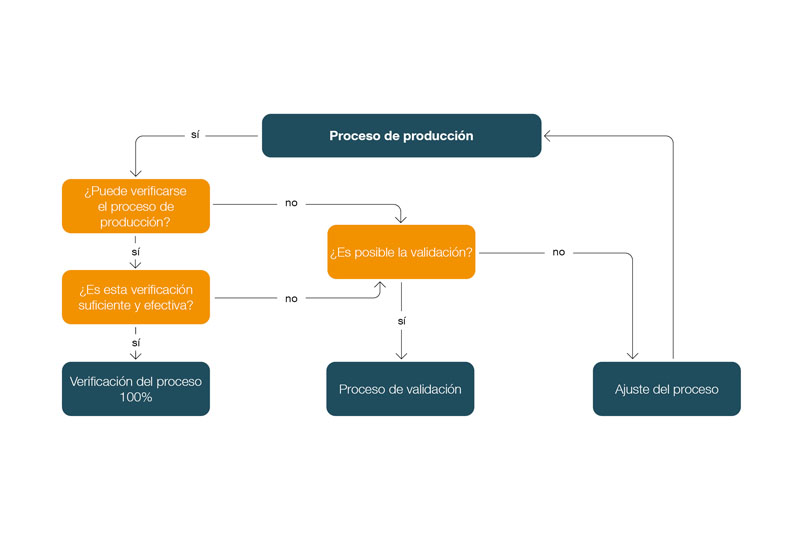
¿Es necesario validar los procesos de fabricación manual en la tecnología médica?
De acuerdo con los requisitos reglamentarios de la norma ISO 13485 y la normativa sobre sistemas de calidad de la FDA, los procesos cuyos resultados no se verifican (suficientemente) o no pueden verificarse requieren una validación, independientemente de que el proceso incluya actividades manuales. Por tanto, los procesos manuales deben considerarse exactamente igual que los automatizados.
Servicios para el cumplimiento de la normativa en tecnología médica
El resultado es el siguiente árbol de decisiones para determinar si un proceso debe ser validado:
¿Qué es un archivo de historial de diseño y qué hay que tener en cuenta al crearlo?
El archivo de historial de diseño (DHF) representa un registro del historial de desarrollo y de los resultados de desarrollo de un producto sanitario. En concreto, se debe documentar:
- Uso previsto del producto
- Requisitos y su detalle con las especificaciones
- Descripción del diseño y funcionamiento
- Planos de construcción
- Planes de prueba para la verificación del diseño
- Planes de prueba para la validación del diseño
¿Cómo se puede estructurar una gestión eficaz de los proveedores para garantizar la calidad de los procesos subcontratados?
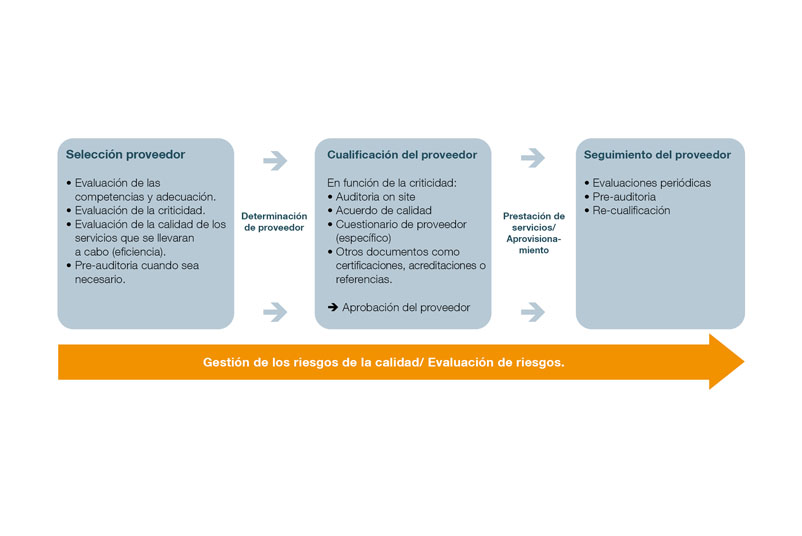
En la práctica, la gestión de los proveedores puede estructurarse en varias etapas e incluir los siguientes pasos:
- Crear un catálogo de evaluación para la selección de proveedores
- Llevar a cabo la cualificación de los proveedores
- Selección de proveedores
- Establecer la supervisión de los proveedores
- Selección de proveedores
- Seguimiento de los proveedores
Procesos externalizados Tecnología médica