¿Cuál es la diferencia entre cualificación y validación?
El área de conocimiento de la Cualificación responde a las preguntas básicas sobre la distinción entre cualificación y validación, las fases de la cualificación y los requisitos de almacenamiento y transporte de los medicamentos.
Caja con anclajes
¿Cuál es la diferencia entre una cualificación y una validación?
La cualificación implica aportar pruebas documentadas de que las instalaciones, los equipos de producción, suministros auxiliares y los locales son adecuados para el fin previsto. La validación, por su parte, proporciona pruebas de la idoneidad de los procesos y procedimientos.
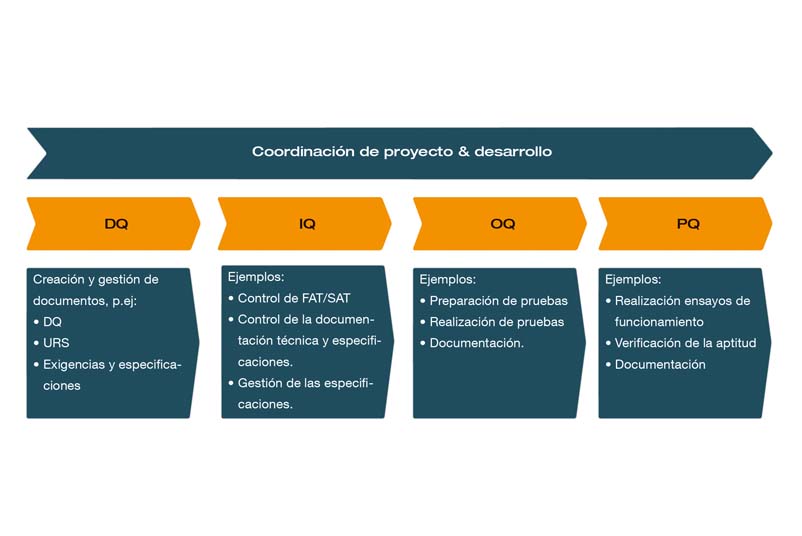
¿Cuáles son las fases de cualificación?
En el ciclo de vida de una planta se distinguen diferentes fases de cualificación:
- DQ: Cualificación del diseño
- IQ: Cualificación de la instalación
- OQ: Cualificación operativa
- PQ: Cualificación del proceso
¿Se aplican los requisitos de alta calidad también al almacenamiento y transporte de los medicamentos?
Sí, los requisitos de alta calidad están firmemente anclados en las Buenas Prácticas de Almacenamiento (GSP) y las Buenas Prácticas de Distribución (GDP). En sus distintas fases, el proceso de almacenamiento y transporte está influido por riesgos de calidad de distinto grado, que deben controlarse adecuadamente. Las medidas de cualificación y validación pueden minimizar estos factores de influencia críticos y demostrar el cumplimiento de los requisitos de GxP.
¿Cuáles son los objetivos de la gestión de riesgos de la calidad según la norma ICH Q9?
Los objetivos son identificar, evaluar y reducir los riesgos que puedan afectar negativamente a la calidad de los productos y, por tanto, a la seguridad de los medicamentos. En este contexto, el riesgo se define como la combinación de la probabilidad de que se produzca una pérdida y su magnitud.